
近日,同濟大學董春燕教授團隊在研究設(shè)計一種納米粒子破壞細胞氧化還原穩(wěn)態(tài)并誘導鐵死亡以抑制三陰性乳腺癌生長中取得新進展�����。相關(guān)研究成果已經(jīng)發(fā)表在國際權(quán)威期刊《Biomaterials》(IF=12.8�����、一區(qū)期刊)上����。
三陰性乳腺癌(TNBC)是乳腺癌中惡性程度極高的亞型�,其特征是免疫原性缺陷和腫瘤微環(huán)境(TME)中免疫細胞浸潤受限��。為了實現(xiàn)有效的腫瘤控制��,迫切需要一種能夠增強腫瘤免疫原性同時改善腫瘤免疫微環(huán)境(TIME)的新治療策略�����。鐵死亡已被證明通過釋放損傷相關(guān)分子來增強細胞免疫原性�����,但長期鐵死亡會刺激炎癥反應���,促使腫瘤發(fā)展���,導致腫瘤免疫微環(huán)境轉(zhuǎn)為免疫抑制狀態(tài),即 “冷” 腫瘤�。因此,在增加免疫原性的同時���,如何有效地將 “冷” 腫瘤轉(zhuǎn)變?yōu)?“熱” 腫瘤���,并維持其免疫激活狀態(tài)顯得尤為關(guān)鍵����。二甲雙胍(MET)作為常用的 2 型糖尿病口服降糖藥�����,在抗腫瘤免疫方面顯示出巨大的潛力����,被認為是一種免疫調(diào)節(jié)劑?��;诖?,本研究旨在通過構(gòu)建一種新型納米平臺�����,結(jié)合光熱治療(PTT)和鐵死亡�����,重塑TIME并增強TNBC的免疫原性��。
在該研究中��,研究團隊成功構(gòu)建了一個自組裝納米平臺(Fe-PDA-MET NP)����,該平臺通過光熱治療(PTT)和鐵死亡的協(xié)同作用,顯著抑制了TNBC的腫瘤生長���。研究結(jié)果表明���,F(xiàn)e-PDA-MET納米顆粒能夠在腫瘤部位高效積累,并在808 nm激光照射下產(chǎn)生強大的光熱效應����,破壞細胞的氧化還原平衡,誘導鐵死亡��。同時����,MET的釋放重塑了TIME,增加了活化的CD8+ T細胞和NK細胞的浸潤��,降低了CD8+T細胞的耗竭��,并通過上調(diào)L-谷氨酰胺水平進一步促進鐵死亡�。
此外����,F(xiàn)e-PDA-MET納米顆粒在體內(nèi)外均展現(xiàn)出良好的生物相容性和抗腫瘤效果���。在體內(nèi)實驗中����,F(xiàn)e-PDA-MET聯(lián)合PTT顯著抑制了原發(fā)腫瘤和遠處腫瘤的生長�����,誘導了強烈的局部和系統(tǒng)性免疫反應����,表現(xiàn)為促炎細胞因子(如TNF-α、IFN-γ和IL-2)的增加以及CD8+T細胞和NK細胞的激活����。通過代謝組學分析,研究進一步證實了MET重塑的TIME能夠通過上調(diào)L-谷氨酰胺水平促進鐵死亡�����。
綜上所述�����,該研究開發(fā)的Fe-PDA-MET納米平臺通過激活鐵死亡正反饋環(huán)路��,克服了傳統(tǒng)TNBC治療的局限性���,為未來臨床應用提供了有前景的治療策略�。
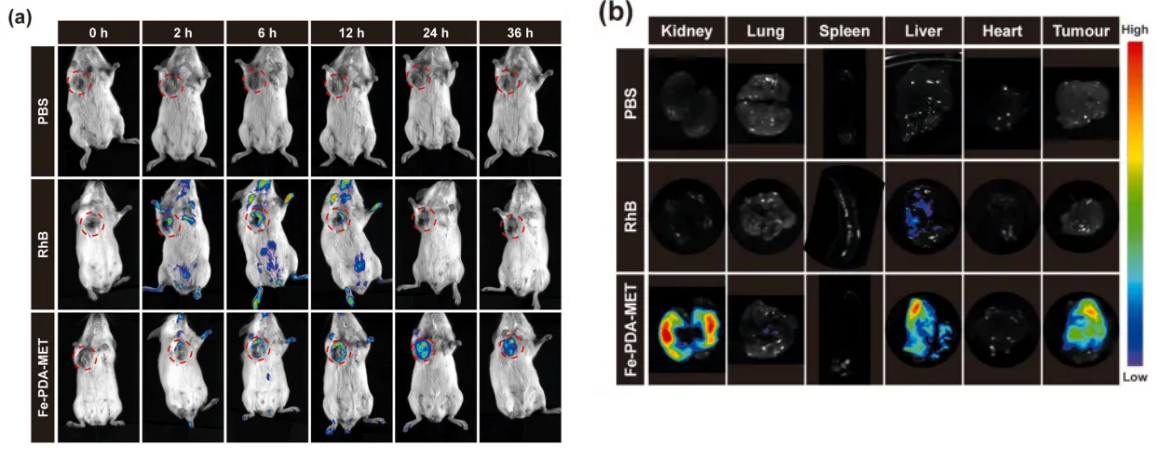
在文章中����,為了驗證納米粒對腫瘤的靶向效應和生物組織分布,研究團隊使用博鷺騰AniView多模式動物活體成像系統(tǒng)對小鼠進行活體和離體組織的熒光成像����。結(jié)果表明,RhB 標記的 Fe-PDA-MET 納米顆粒在靜脈注射 2h 后可在腫瘤部位檢測到熒光信號��,24h 時信號強度達到最大�,36h 時仍能檢測到,這表明 Fe-PDA-MET NPs 能夠在腫瘤部位有效積累�,且在體內(nèi)具有較長的留存時間,而游離 RhB 會被快速代謝�����。

論文鏈接:
https://doi.org/10.1016/j.biomaterials.2024.122960