近日���,深圳市第七人民醫(yī)院陳宇團隊在開發(fā)用于治療卵巢癌的納米顆粒方面取得了研究進展�。相關(guān)研究成果已發(fā)表在國際知名期刊《ACS Applied Materials & Interfaces》(IF=9.229���、一區(qū)top期刊)上��。

△ 圖1
國際知名期刊《ACS Applied Materials & Interfaces》
卵巢癌是婦科常見的惡性腫瘤之一�。腹腔化療已被證明是一種有效的臨床治療播散性胃腸道和婦科癌癥的方法����,可以增加治療藥物對癌細胞的接觸,減少全身毒性����。然而,晚期卵巢癌患者在進行化療后���,腫瘤容易復(fù)發(fā)�����。研究表明�,在對抗腫瘤異質(zhì)性和耐藥性方面,多機制誘導(dǎo)腫瘤細胞死亡似乎優(yōu)于單一靶向途徑�����。
阿霉素(DOX)是一種治療卵巢癌鉑基耐藥的二線化療藥物�����,可通過抑制DNA復(fù)制從而抑制腫瘤進展�,該藥物也已被證實可破壞細胞內(nèi)氧化還原狀態(tài)的平衡,誘導(dǎo)內(nèi)質(zhì)網(wǎng)應(yīng)激�。但是由于藥物缺乏對腫瘤的選擇性,所以通常需要高劑量的DOX才能達到有效的化療效果�,并且即使在局部應(yīng)用藥物也會引起全身的副作用。
在本研究中�,陳宇團隊通過原位礦化法構(gòu)建了負載DOX的納米磷酸鈣(CaPO),并將Arg- Gory - Asp (RGD)序列進一步修飾在CaPO表面���,通過靶向卵巢腫瘤中高表達的整合素αvβ3,實現(xiàn)了對卵巢癌的高效治療���。這些經(jīng)過合理設(shè)計的RGD-CaPO/DOX NPs可被人卵巢癌細胞系SKOV3有效吞噬���,釋放DOX和Ca2+�。DOX提高細胞內(nèi)活性氧(ROS)水平��,誘導(dǎo)內(nèi)質(zhì)網(wǎng)應(yīng)激����,進一步促進Ca2+穩(wěn)態(tài)失衡,最終導(dǎo)致腫瘤細胞凋亡�����。這些不同的鈣參與的NPs為腹腔內(nèi)播散性卵巢癌提供了一種有效的協(xié)同治療���,且其生物毒性可以忽略不計���。
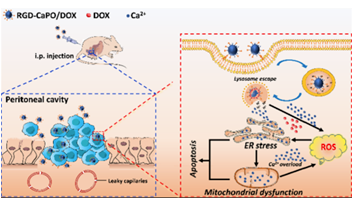
△ 圖2
針對RGD-CaPO/DOX系統(tǒng)的研究策略
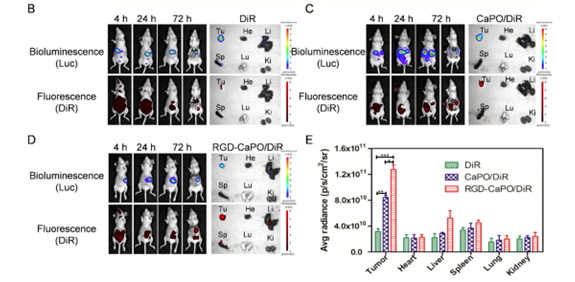
△ 圖3
CaPO/DiR 和 RGD-CaPO/DiR NPs 的體內(nèi)生物分布
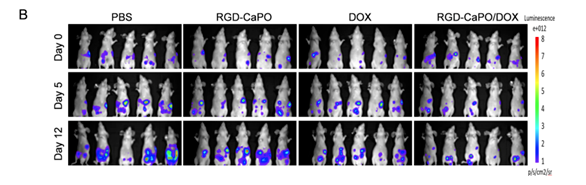
△ 圖4
分別用 PBS、RGD-CaPO (50 mg kg-1) 處理的 SKOV3-Luc 荷瘤小鼠的生物發(fā)光圖像
本研究設(shè)計并構(gòu)建了多功能RGD-CaPO/DOX系統(tǒng)�����,以實現(xiàn)腹腔內(nèi)播散性卵巢癌的有效協(xié)同治療。RGD-CaPO/DOX系統(tǒng)具有時間依賴性的細胞吸收���、ph敏感性降解和體外藥物釋放���。活體熒光成像表明���,RGD-CaPO NPs在腫瘤中有特異性積累����,而在其他器官中幾乎不可見�,這清楚地表明該藥物具有顯著的腫瘤選擇性。在SKOV3荷瘤小鼠模型中�,腹腔注射RGD-CaPO/DOX可有效抑制腫瘤進展,小鼠的平均生存時間由29天延長至59天����。
綜上所述,陳宇團隊的研究為卵巢癌的治療提供了一種有效的鈣摻雜納米藥物與ROS誘導(dǎo)化療藥物負載的化療增強策略��。

在進行CaPO/DiR標記小鼠與SKOV3-Luc小鼠活體成像的實驗中�����,使用了AniView系列多模式動物活體成像系統(tǒng)進行拍攝。
論文鏈接https://doi.org/10.1021/acsami.2c02552