近日�����,廣州醫(yī)科大學第一附屬醫(yī)院泌尿外科曾國華團隊在腎細胞癌機制研究方面取得了研究進展�。相關研究成果已發(fā)表在國際知名期刊《Molecular Cancer》(IF= 27.7、一區(qū)top期刊)上���。

腎細胞癌(RCC)是全球最常見的泌尿系統(tǒng)惡性腫瘤之一��,占美國新診斷癌癥病例的4%以上���。其中,透明細胞腎細胞癌(ccRCC)是最常見的類型���,約占RCC的75%。盡管早期ccRCC可以通過手術治愈�,但約30-50%的病例最終會發(fā)展為致命的異時性遠處轉(zhuǎn)移。因此�,深入研究RCC發(fā)生和發(fā)展的分子特征是非常必要的���。
環(huán)狀RNA(circRNA)不同于線性RNA����,具有獨特的共價閉合環(huán)結(jié)構(gòu),賦予其在生物過程中獨特的調(diào)控功能��。盡管最初被視為“剪接錯誤”或轉(zhuǎn)錄副產(chǎn)品�,但已有研究識別出超過16000種顯著的環(huán)狀RNA,這些RNA在多個腫瘤樣本中具有高保守性和穩(wěn)定性��,使其成為有前途的生物標志物�����。
在癌癥進展中�����,circRNA發(fā)揮著重要的致癌或抗癌作用��。例如����,circRNA-cRAPGEF5通過海綿吸附miR-27a-3p在RCC中發(fā)揮抗癌作用����,而CircMET通過與CDKN2A mRNA和miR-1197相互作用促進RCC的增殖。此外,CircPOLR2A通過與UBE3C和PEBP1蛋白結(jié)合�,加速了ccRCC細胞的侵襲和血管生成,進而通過調(diào)控ERK信號通路促進ccRCC的發(fā)展���。癌癥相關成纖維細胞(CAFs)作為腫瘤基質(zhì)中的主要細胞類型����,在促進癌癥的進展和轉(zhuǎn)移方面起著關鍵作用����。CAFs主要起源于組織駐留的成纖維細胞����,表現(xiàn)出高異質(zhì)性,并表達特定的標志物�,如α-平滑肌肌動蛋白(α-SMA)。此外���,CAFs通過表達IL-6、IL-8��、TGF-β和膠原蛋白等促炎基因調(diào)控炎癥微環(huán)境��。
細胞外囊泡(EVs)是由各種類型細胞釋放的含有脂質(zhì)�����、蛋白質(zhì)和核酸(包括circRNA)的顆粒��。研究證實���,癌細胞來源的EVs可作為信使�����,通過傳遞生物活性分子到遠處器官���,誘導實質(zhì)信號響應并重塑轉(zhuǎn)移部位的微環(huán)境。例如�,非小細胞肺癌來源的EVs可將LINC00482傳遞到小膠質(zhì)細胞,從而促進小膠質(zhì)細胞的M2極化并促進腦轉(zhuǎn)移�����。此外��,結(jié)直腸癌來源的EVs中的Tgf-β1可以增強肝臟前轉(zhuǎn)移免疫抑制性生態(tài)位的形成并促進早期肝轉(zhuǎn)移��。盡管如此��,EVs-circRNAs在RCC轉(zhuǎn)移中的潛在機制仍不清楚����。
在此研究中,研究人員鑒定出一種新的環(huán)狀RNA���,稱為circEHD2(circbase ID:hsa_circ_0003146)�,它在ccRCC組織中顯著上調(diào)�,并與ccRCC患者的預后不良相關�����。circEHD2通過circEHD2/YWHAH/YAP/SOX9通路增強了RCC的生長��,而EVs-circEHD2通過將成纖維細胞轉(zhuǎn)化為CAFs促進了RCC的轉(zhuǎn)移��。綜上所述���,該研究表明���,EVs-circEHD2在RCC的進展中起著關鍵作用,表明EVs-circEHD2可能成為RCC的潛在治療靶點��。
文章中��,在利用luc標記檢測肺轉(zhuǎn)移模型及監(jiān)測左腎下囊內(nèi)的原位腫瘤生長的實驗中�,使用了博鷺騰Aniview多模式動物活體成像系統(tǒng)進行成像及分析��。
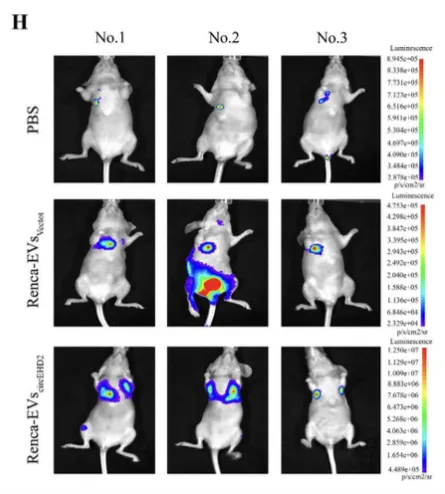
圖1 用 PBS(n=3/組)����、Renca-EVsVector(n=3/組)和 Renca-EVscircEHD2 (n=3/組)處理的肺轉(zhuǎn)移模型活體生物發(fā)光成像

圖2 左腎下囊內(nèi)的原位腫瘤生長監(jiān)測

論文鏈接:https://doi.org/10.1186/s12943-023-01824-9